Fiche de tri
https://www.mri.cnrs.fr/images/documents/E_MRI_DOC_0029_F_DEMANDE_DE_TRI.docx
Elle doit nous être envoyée
par mail au moment de la réservation pour qu’on puisse valider
la faisabilité du tri (fluorochromes utilisés et durée du tri)
. Pour les tris avec incertitude, la fiche de tri doit nous
être envoyée au plus tard la veille du tri. Quand vous faites
la même expérience avec les mêmes marqueurs plusieurs fois
d’affilée, vous pouvez envoyer une seule fiche de tri
indiquant la période concernée.
Nombre de cellules «triables» et durée du tri
Deux tailles de buses
possibles (70 et 100 microns), qui permettent de trier une
large gamme de tailles de cellules. Agrandir la taille de la
buse permet aussi de trier des cellules à une pression
inférieure (pour les cellules fragiles).
-A basse pression (buse
100µ/15 PSI) la vitesse maximale est d’environ 3 000
cellules/seconde. Il est donc possible de trier au maximum 11
000 000 cellules/heure.
-A pression intermédiaire
(buse 100µ/25 PSI) la vitesse maximale est d’environ
5 000 cellules/seconde. Il est donc possible de trier au
maximum 18 000 000 cellules/heure.
-A haute pression (buse
70µ/68 PSI) la vitesse maximale est d’environ 20 000
cellules/seconde. Il est donc possible de trier au maximum au
70 000 000 cellules/heure.
Attention : Ces chiffres prennent en
compte tous les évènements détectés par le trieur y compris
les cellules mortes et les débris. En tenir compte dans vos
calculs.
Exemple de calcul : Même si l’efficience du tri est souvent
entre 75 % et 95 %, il faut toujours calculer le
nombre de cellules de départ en se basant sur une efficience
de 50 % afin d’être sur d’avoir suffisamment de cellules.
Si la population d’intérêt représente par exemple 10 % de
la totalité de l’échantillon, pour avoir 1M de cellules triées
il faudra partir de 20M de cellules.
Exemple de
calcul de temps de tri
Taille
Buse/Pression
100µ/15
PSI
100µ/25
PSI
70µ/68
PSI
Type
cellulaire
Cellules
très fragiles
Conditions
intermédiaire
Petites
cellules non fragiles
Vitesse
moyenne de tri
1
000-3 000 evts/sec
2
000-5 000 evts/sec
10
000-20 000 evts/sec
Temps
nécessaire*
environ
3 heures
environ 1
heure 30
environ
20 minutes
Contrôles
Pour la cytométrie
spectrale, nous avons besoin d’extraire les spectres des
fluorochromes utilisés un par un.
A cette fin, il faudra
apporter :
1) Des cellules totalement
non marquées. L’autofluorescence des cellules est en effet
considerée comme un fluorochrome. Il est donc possible
d’évaluer le spectre d’autofluorescence et le soustraire aux
signaux de fluorescence.
2) Tous les monomarquages
individuels. La
préparation du monomarquage doit être identique à celle de
l’échantillon (dissociation, lavages, perméabilisation,
fixation…). En cas d’incertitude sur la présence d’un marqueur
sur vos cellules (ou de manque de cellules pour les contrôles)
et afin de faire l’extraction du spectre, il vous faudra
prévoir des billes qui fixent vos anticorps. Les billes
doivent subir les mêmes traitements que les cellules. Il
existe aussi des billes spécifiques pour les marqueurs de
viabilité.
Attention : Il faut éviter d'utiliser des billes pour les
fluorochromes tandems (par exemple : PE-Cy5.5, APC-Cy7,
BV570, QDOT655..) car l'extraction des spectres ne se fait
pas correctement quand elle est appliquée aux cellules :
Attention : Pour le contrôle
non marqué, il nous faut minimum 100 000 cellules (dans
environ 200-300 µl) et pour les contrôles positifs nous avons
besoin de minimum 200 cellules positives afin d’extraire les
spectres.
Choix
des fluorochromes
https://welcome.cytekbio.com/hubfs/Website%20Downloadable%20Content/Data%20Sheets/Fluorochrome%20Guides/N9_20018_Rev._A_4L_VBYGR_Fluor_Guide.pdf
-les
longueurs d’onde d’excitation des fluorochromes
correspondent aux sources lumineuses du cytomètre,
-les
longueurs d’onde d’émission sont suffisamment éloignées
pour que leurs signaux soient analysés séparément.
-les
antigènes faiblement exprimés sont révélés par des
fluorochromes à fort rendement et les antigènes fortement
exprimés avec des fluorochromes à faible rendement. Pour
vous aider sur ce point, les principaux fluorochromes sont
présentés avec leur brillance (stain index) dans la figure
suivante :
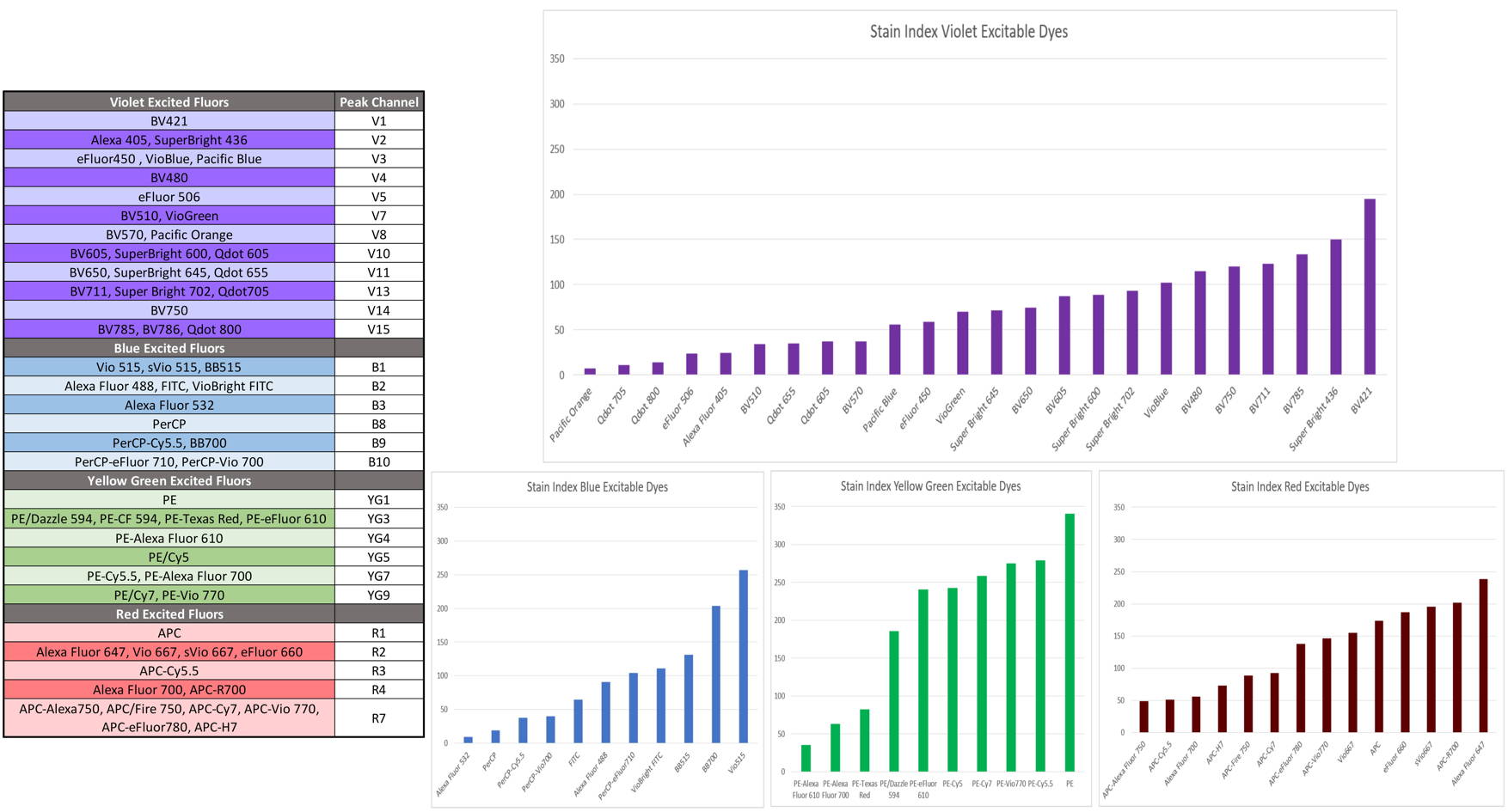
-dans
le cas d’une co-expression sur une cellule, utiliser des
fluorochromes dont les spectres se chevauchent peu ou pas.
Elimination des cellules mortes
L’élimination des cellules
mortes peut se faire sur la base des paramètres physiques side
scatter (SSC) et forward scatter
(FSC) pour des échantillons de lignées cellulaires. L’addition
d’un marqueur de cellules mortes (comme l’Iodure de propidium,
le DAPI, Sytox…) permet une élimination plus précise pour des
échantillons plus complexes. En cas d’utilisation d’un
marqueur de viabilité, le contrôle négatif (unstained) ne doit
pas contenir le marqueur.
Filtration des cellules
La filtration des cellules,
juste avant le passage au trieur, permet d’éviter les
bouchages qui déstabilisent le tri et diminuent la pureté des
fractions récoltées. Pour cela vous pouvez utiliser des
filtres à 40 microns.
Conditionnement des cellules avant tri
Les cellules peuvent être
apportées dans du PBS ou du milieu de culture.
Les cellules doivent être
apportées dans des tubes de 5ml (référence Falcon 2054) sous
un volume minimum de 300 µl à:
⁃
5x106 cellules/ml maximum
pour un tri basse pression
⁃
1x107
cellules/ml maximum pour un
tri pression intermédiaire
⁃
2-5x107 cellules/ml maximum
pour un tri haute pression
Attention :
Plus
le volume à passer est grand, plus long sera le tri.
Tubes de récolte
Les cellules peuvent être
récoltées après tri dans des tubes (tubes Eppendorf 1,5ml,
tubes FACS de 5ml, tubes falcon de 15ml) ou des plaques (96,
24,12 et 6 puits). Il est conseillé de mettre du milieu de
culture dans les tubes de collections.
Avec la buse 100µ on peut
récupérer environ :
⁃
1x106 cellules dans un tube
de 5ml
⁃
3x106 cellules dans un tube
de 15ml
avec la buse 70µ :
⁃
3x106 cellules
dans un tube de 5ml
⁃
9x106 cellules
dans un tube de 15ml
Adapter le nombre de tubes
de récolte au nombre estimé de cellules recueillies pour
chaque fraction.