IMMUNOFLUORESCENCE POUR LA CARACTERISATION DES SOUS-POPULATIONS
CELLULAIRES
L’hématologie a été l’une des
premières disciplines médicales à bénéficier des applications
cliniques de la CMF. Certaines de ces applications sont maintenant
utilisées régulièrement pour le diagnostic ou le suivi
thérapeutique de différentes affections. Ces applications
concernent aussi bien l’étude fonctionnelle de cellules saines que
la mise en évidence du caractère pathologique des cellules
analysées.
L’association de
l'immunofluorescence et de la cytométrie en flux (CMF) est devenue
un élément essentiel dans l’étude des systèmes biologiques,
surtout dans la discrimination entre cellules d’une population
hétérogène. En effet, l’utilisation des anticorps monoclonaux
(AcM), dirigés contre des composants spécifiques, permet de
distinguer des sous-populations lymphocytaires. Ces dernières
années, l’identification et la caractérisation des antigènes (Ag)
de surface des lymphocytes a progressé très rapidement. Cependant,
il n’existe pas d’AcM pouvant reconnaître à lui seul une cellule
particulière pourvue de certaines fonctions. Cette limitation a
conduit les utilisateurs de la technique d’immunofluorescence à
passer des simples aux multiples marquages en utilisant des
combinaisons d’AcM révélés par des fluorochromes différents.
Par rapport aux investigations initiales réalisées au microscope,
la CMF apporte en plus la quantification à l’échelon cellulaire
individuel du nombre de sites reconnus et la possibilité de trier
ces cellules selon l’intensité de leur marquage en vue d’études
fonctionnelles ultérieures. Enfin elle peut se combiner à
l’analyse d’autres paramètres (cycle cellulaire, Calcium) et donc
nous informer sur l’état fonctionnel des cellules.
Principes de
l’immunofluorescence
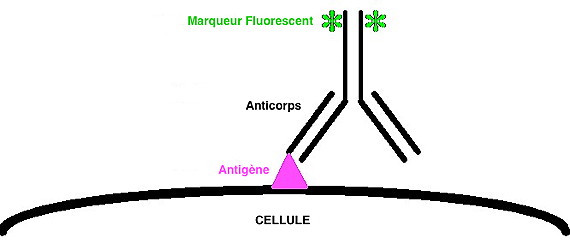
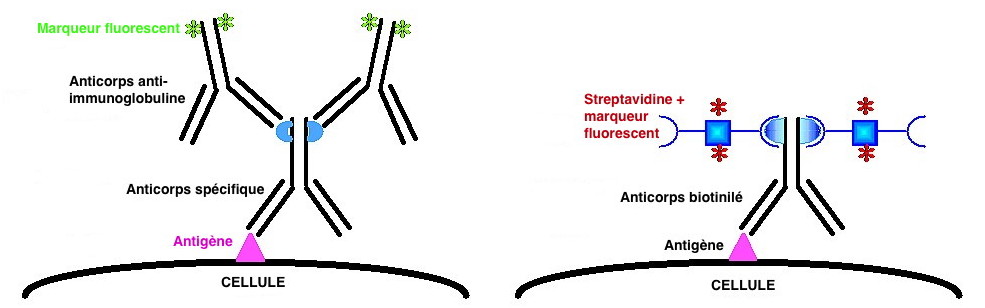
Les méthodes d’immunofluorescence se répartissent en deux groupes:
Les réactions directes où l’AcM est directement couplé à un
fluorochrome :
Les réactions indirectes où l’AcM est révélé par un second réactif
couplé au fluorochrome :
Ces deux méthodes font appel à des
réactifs fluorescents, des anticorps couplé à des fluorochromes.
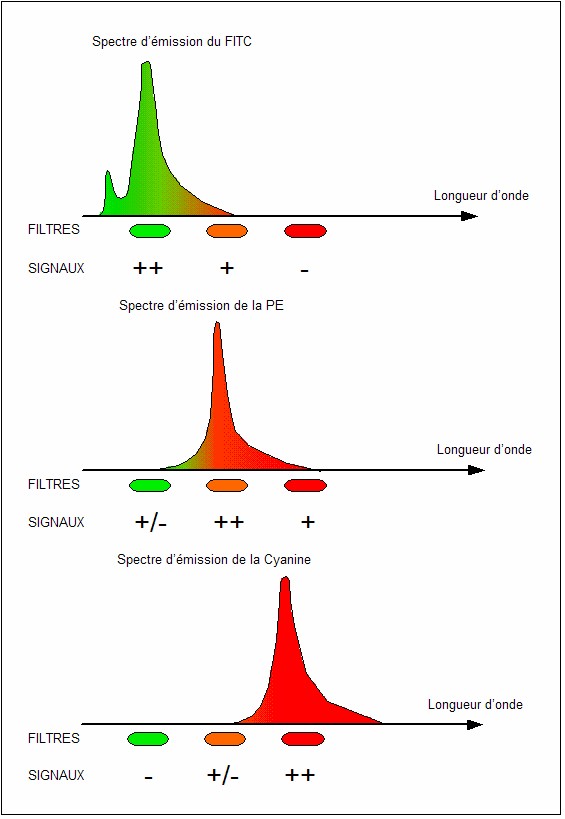
Un exemple de spectres d’émission de fluorochromes utilisé en
immunofluorescence est représenté figure 1.
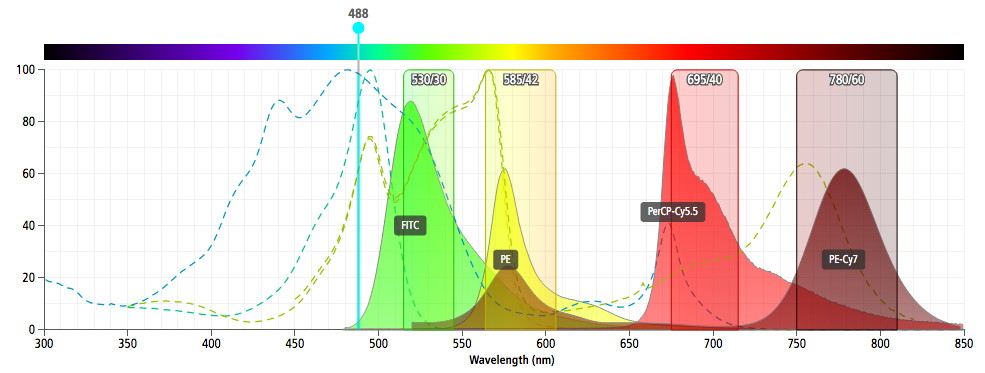 Figure
1 : Spectres d'émission de 3 fluorochromes utilisés en
immunofluorescence.(© Becton Dickinson, Spectra
Viewer)
Figure
1 : Spectres d'émission de 3 fluorochromes utilisés en
immunofluorescence.(© Becton Dickinson, Spectra
Viewer)
Pour les marquages multiples
plusieurs fluorochromes sont utilisés simultanément.
Dans ce cas, il faut que:
-leurs longueurs d’onde d’excitation correspondent aux sources
lumineuses du cytomètre,
-leurs longueurs d’onde d’émission soient suffisamment éloignées
pour que leurs signaux soient analysés séparément.
-les antigènes faiblement exprimés soient révélés par des
fluorochromes à fort rendement et les antigènes fortement exprimés
avec des fluorochromes à faible rendement.
-dans le cas d’une co-expression sur une cellule, utiliser des
fluorochromes dont les spectres se chevauchent peu ou pas.
L’obstacle majeur dans les analyses multiparamétriques est
constitué par le chevauchement important des spectres d’émission
des fluorochromes employés pour révéler les AcM.
L'introduction de plusieurs lasers dans les cytomètres a permis de
vaincre une telle interférence en rendant possible l’excitation de
plusieurs fluorochromes à spectres d’excitation et d’émission bien
distincts.
Pour faciliter le choix des fluorochromes, il existe de nombreux
outils sur proposés par des sociétés privées :
Becton
Dickinson,
Thermo
Fischer,
BioLegend,
Chroma...
La
cytométrie
spectrale, nouvellement arrivée sur le marché améliore de
façon significative la séparation des divers fluorochromes. Elle
propose aussi ses outils pour caractériser les fluorochromes :
Cytek
Avant de démarrer tout protocole d'immuno-marquage il est
important de vérifier la qualité des réactifs utilisés en testant
ceux-ci sur des cellules dont on sait qu'elles présentent
l'antigène analysé.
Il faut tester la concentration à
laquelle le réactif est efficace en marquant ces cellules avec
diverses concentrations du réactif et tracer une courbe de
l'intensité de marquage en fonction de cette concentration (Figure
2):
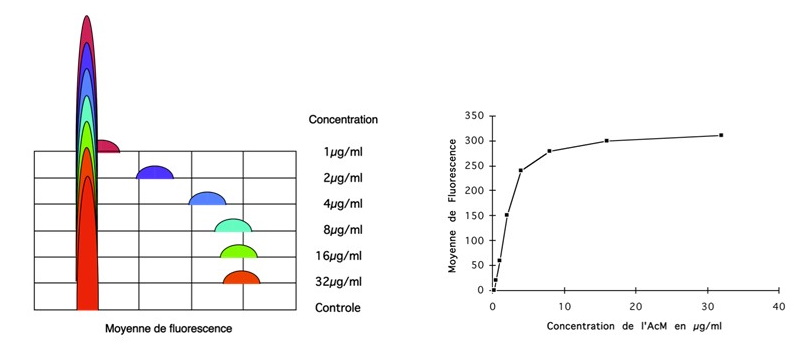
Figure 2 : Effet de la
concentration d'un anticorps sur sa capacité de marquage.
Principes de la compensation de fluorescence
Les chevauchements des spectres
d’émission des divers fluorochromes utilisés en cytométrie
nécessite l’emploi de compensations électroniques de fluorescence
afin de soustraire la superposition des deux signaux de
fluorescence (figure 3).
 Figure
3 : Fuites de fluorescence.
Figure
3 : Fuites de fluorescence.
Ainsi, sans compensation de
fluorescence, une population cellulaire marquée en fluorescence
verte (FITC) mais non marquée en fluorescence orange (PE) est
positionnée sur la bissectrice de l’histogramme biparamétrique des
deux fluorescences (figure 4a).
Le système de compensation permet de soustraire artificiellement
la fluorescence orange qui résulte de la fuite de fluorescence du
FITC dans le canal de la PE (figure 4b).
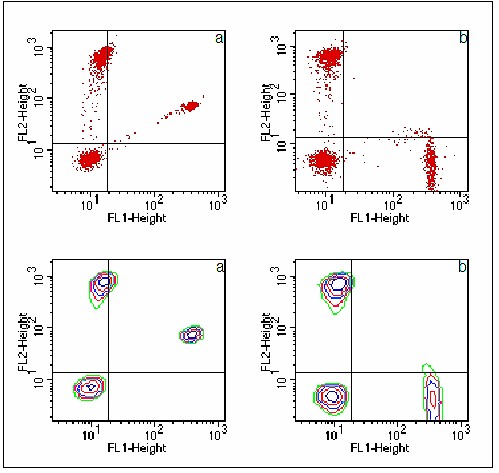
Figure 4 : Effet de la compensation de fluorescence
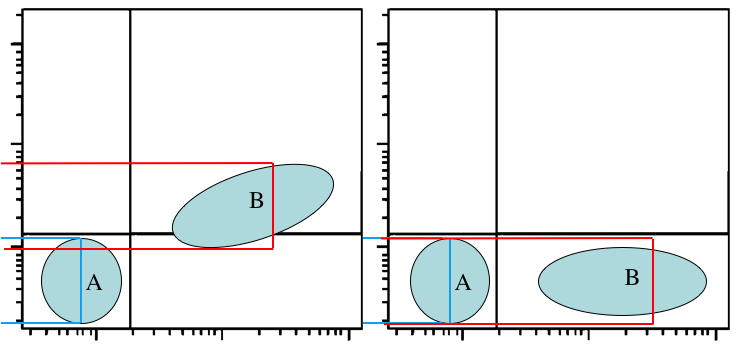
Chaque pourcentage de compensation
sera ainsi déterminé par l’analyse des cellules simplement
marquées par les divers colorants. Il conviendra de régler
correctement les cellules négatives (A) et ensuite d'ajuster la
médiane sur y de la population positive sur x (B) de manière à ce
qu'elle soit égale à celle sur y des cellules négatives (Figure
5).
 Figure
5 : Méthode de calcul de la compensation de fluorescence :
La
médiane de la population B sur l’axe Y doit être égale à la
médiane de la population A sur ce même axe.
Figure
5 : Méthode de calcul de la compensation de fluorescence :
La
médiane de la population B sur l’axe Y doit être égale à la
médiane de la population A sur ce même axe.
La pratique courante pour déterminer un seuil de positivité
consiste à utiliser le 'marquage' isotypique et de positionner un
curseur au pied du pic des cellules négatives. Cette pratique
n'est pas recommandée dans le cadre des marquages multiples. En
effet, quand plus d’une fluorescence est présente et que la
compensation est réglée, la valeur négative du marquage peut être
plus grande que dans un tube non marqué. Pour pallier à ce
problème il faut utiliser la méthode FMO (fluorescences minus one)
qui consiste à consiste à marquer les cellules avec tous les
marqueurs présents dans l’étude sauf celui d’intérêt (Figure 6).
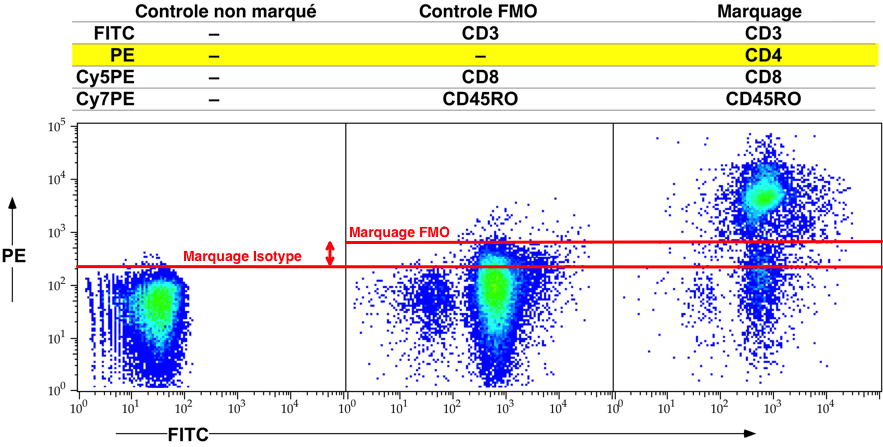 Figure
6 : Positionnement du seuil de positivité, méthode FMO
Figure
6 : Positionnement du seuil de positivité, méthode FMO
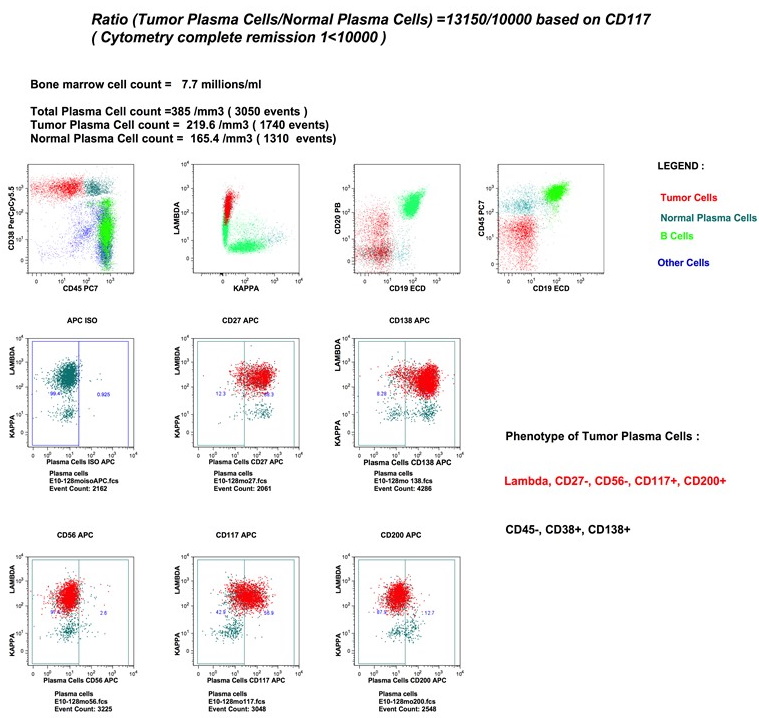
Une fois tous les contrôles et
réglages effectués, les analyses en immunofluorescences peuvent
être menées comme par exemple la recherche de cellules tumorales
dans la moelle de patients atteints de Myélome Multiple (Figure
7)
Figure 7 : Multimarquage
pour le suivi des cellules tumorales dans la moelle de
patients atteints de myélome multiple